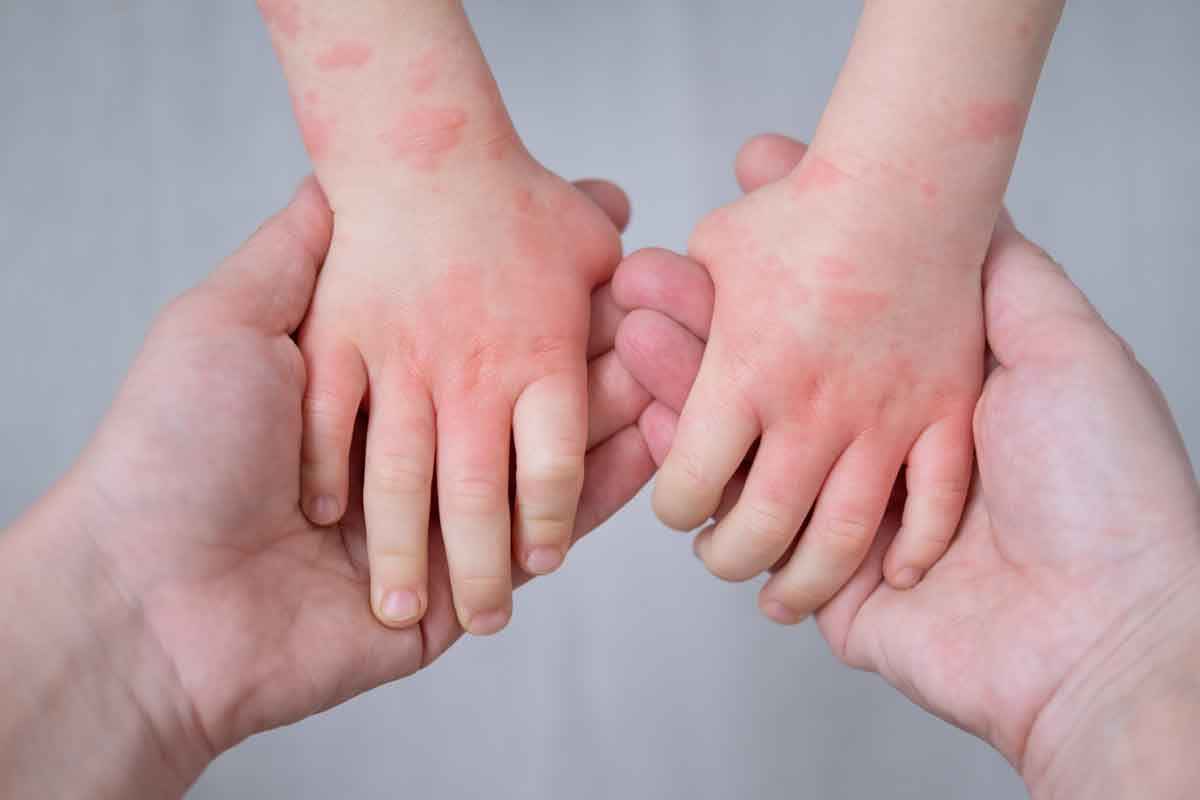
Johnson & Johnson ha comunicado que la Comisión Europea (CE) ha ampliado la autorización de comercialización de TREMFYA® (guselkumab) para el tratamiento subcutáneo de la psoriasis en placas de moderada a grave en niños y adolescentes a partir de 6 años candidatos a terapia sistémica. La decisión sitúa a guselkumab como el primer inhibidor de IL-23 con indicación pediátrica en psoriasis en la UE para ese rango de edad, después de su aprobación en adultos en 2017.
La medida llega en un contexto en el que la psoriasis no es solo una patología de adultos. Según la compañía, casi un tercio de los casos debuta en la infancia, y las placas inflamadas pueden causar picor o dolor, con un impacto emocional relevante durante etapas escolares. Además, la psoriasis pediátrica se ha asociado a comorbilidades como obesidad, hipertensión, hiperlipidemia, diabetes mellitus y artritis psoriásica, lo que añade carga clínica y afecta a la calidad de vida.
Una brecha terapéutica en los casos pediátricos
“A pesar de los avances en el tratamiento de la psoriasis pediátrica, sigue habiendo una brecha significativa en las terapias disponibles”, ha señalado Marieke Seyger, profesora asociada del Centro Médico Universitario Radboud de Nijmegen (Países Bajos) e investigadora del estudio PROTOSTAR. En su valoración, la aprobación de guselkumab abre una opción que puede “mejorar significativamente los signos y síntomas” en niños que conviven con esta enfermedad inmunomediada.
El anuncio refuerza la tendencia de la dermatología a ampliar el arsenal biológico en edades tempranas, especialmente en pacientes con psoriasis moderada o grave en los que el control sostenido no solo busca reducir lesiones, sino también limitar repercusiones físicas y psicosociales.
PROTOSTAR: más respuesta clínica a la semana 16
La ampliación de indicación se sustenta en los resultados del ensayo fase 3 PROTOSTAR, con 120 pacientes pediátricos con psoriasis en placas de moderada a grave, junto con datos farmacocinéticos de los estudios fase 3 VOYAGE 1 y 2 en adultos.
En PROTOSTAR, los objetivos coprimarios se evaluaron en la semana 16: PASI 75 e IGA 0/1. En el grupo tratado con guselkumab, aproximadamente el 76% alcanzó PASI 75, frente al 20% con placebo (p < 0,001). En el mismo corte temporal, el 66% logró IGA 0/1 (aclaramiento alto de la piel) frente al 16% con placebo (p < 0,001). Además, cerca del 40% consiguió aclaramiento completo (IGA 0) frente al 4% con placebo (p < 0,01). En seguridad, la compañía indica que el perfil en pacientes de 6 a 17 años fue coherente con el observado en adultos.
Desde Johnson & Johnson Innovative Medicine, Mark Graham, director del Área Terapéutica de Inmunología para Europa, Oriente Medio y África, ha enmarcado la decisión como “un importante paso adelante” para pacientes y familias, y ha reiterado el compromiso de seguir generando evidencia sobre eficacia a largo plazo y seguridad.
Guselkumab recibió su primera aprobación en la UE en noviembre de 2017 para psoriasis en placas moderada a grave en adultos, amplió indicación en noviembre de 2020 para artritis psoriásica activa en adultos y, en 2025, obtuvo autorización de la CE para colitis ulcerosa y enfermedad de Crohn en adultos, con esquemas que incluyen inducción intravenosa o subcutánea y mantenimiento subcutáneo.