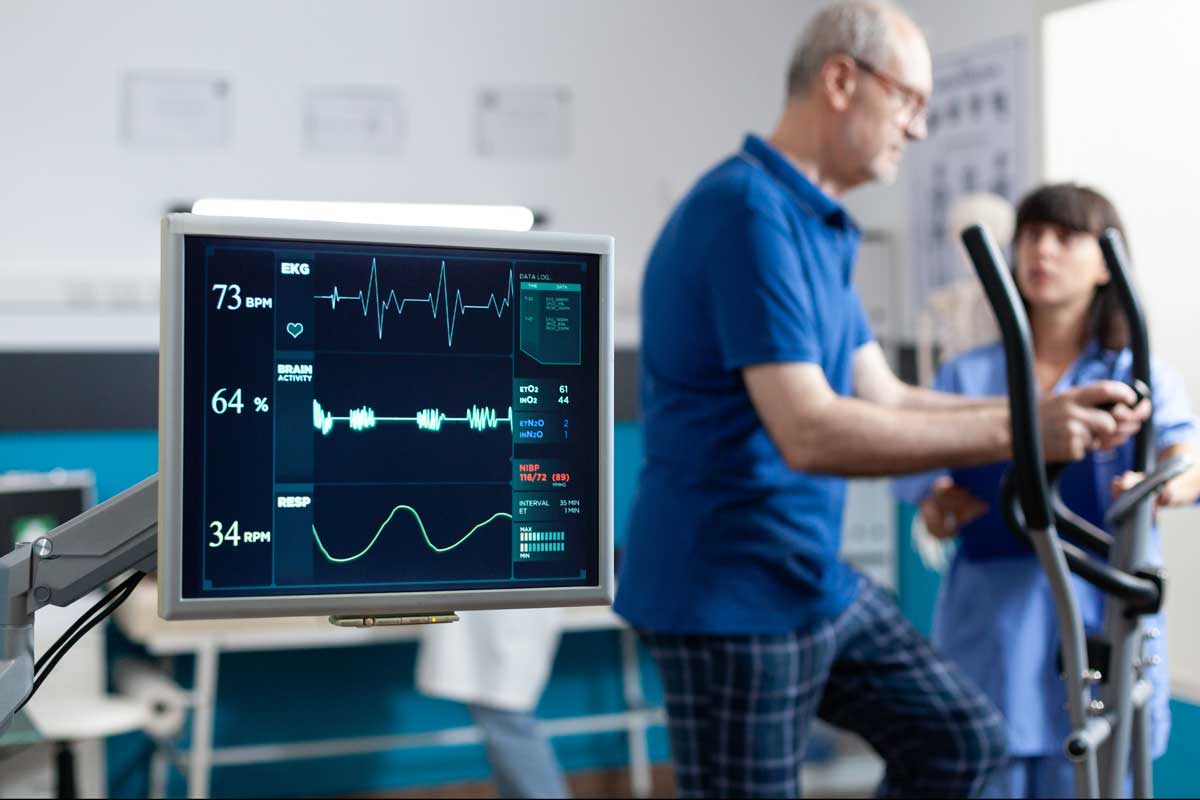
Bristol Myers Squibb ha anunciado que el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha recomendado la aprobación de CAMZYOS (mavacamten) para el tratamiento de la miocardiopatía hipertrófica obstructiva (MCHo) sintomática en pacientes adultos. La Comisión Europea (CE), autoridad competente para conceder la autorización de comercialización de los medicamentos para la Unión Europea (UE), revisará ahora la opinión del CHMP.
Mavacamten es el primer y único inhibidor de la miosina cardiaca aprobado en Estados Unidos indicado para el tratamiento de adultos con miocardiopatía hipertrófica obstructiva (MCHo) sintomática y clase funcional II-III de la New York Heart Association (NYHA) para mejorar la capacidad funcional y los síntomas. También ha sido aprobado por las autoridades reguladoras de Australia, Canadá, Brasil y Suiza. Mavacamten es un inhibidor alostérico y reversible selectivo para la miosina cardiaca. Este tratamiento modula el número de cabezas de miosina que pueden entrar en estados “sobre actina” (generadores de fuerza), reduciendo así la probabilidad de formación de puentes cruzados productores de fuerza (sistólicos) y residuales (diastólicos). El exceso de formación de puentes cruzados de miosina y actina y la desregulación del estado superrelajado son características del mecanismo de la MCH. Mavacamten desplaza la cantidad general de miosina hacia un estado superrelajado, reclutable y ahorrador de energía. En los pacientes con MCH, la inhibición de la miosina con mavacamten reduce la obstrucción dinámica del TSVI y mejora las presiones de llenado cardiaco.
“La miocardiopatía hipertrófica obstructiva puede ser una enfermedad cardiaca debilitante que puede cambiar la vida de quien la padece, reduciendo sus facultades físicas y su bienestar general, y con frecuencia es hereditaria. Para los pacientes de la UE, todavía no existe ningún tratamiento aprobado que actúe frente a la causa subyacente de esta enfermedad, a pesar de su prevalencia mundial y de sus síntomas debilitantes”, señala el doctor Roland Chen, Vicepresidente de Desarrollo Cardiovascular en Bristol Myers Squibb. “La recomendación positiva del CHMP nos sirve de estímulo, ya que nos sitúa un paso más cerca de hacer llegar a los pacientes de la UE el primer medicamento en su clase para la MCHo, y refuerza nuestro compromiso con el desarrollo de tratamientos cardiovasculares transformadores para los pacientes de todo el mundo”.